You can not select more than 25 topics
Topics must start with a letter or number, can include dashes ('-') and can be up to 35 characters long.
2.3 KiB
2.3 KiB
参考法规/指南
密理博课件
美国GMP:US GMP 21 CFR Parts 210 &211
欧盟GMP:EU GMP Annex 1 Sterile Medicinal Products
FDA无菌工艺指南(2004版): FDA Aseptic Processing Guidelines
PDA技术报告26:PDA Technical Report 26
ISO/DIS 13408-2 无菌工艺:ISO/DIS 13408-2 Aseptic Processing
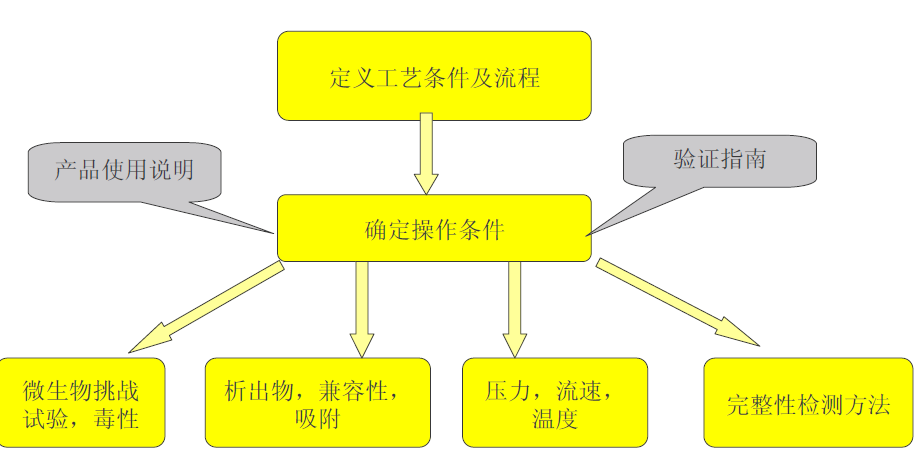
目的:为什么要进行除菌过滤器验证
确保无菌工艺的稳定性及可重现性
各国法规的要求
职责
滤器供应商
过滤器设计确认
过滤器制造确认
过滤器质量检验
批次细菌挑战试验,100%滤器完整性测试
提供过滤器验证指南(产品的验证信息)
滤器使用方
根本上负责过滤器的验证,利用外部有测试资质的实验室进行过滤器验证测试是可被接受的
审计过滤器供应商-生产设施及质量管理体系
过滤器的选型(在滤器生产商的指导下进行)
过滤器/产品特定的验证研究
确定过滤器与产物之间的兼容性-通过适当的过滤器筛选,化学兼容性表及产物测试
工艺验证:验证每一个过滤工艺
验证过滤器灭菌次数(重复使用)
验证清洁次数(重复使用)
在过滤器的参数范围内进行操作
确认操作员资质
流程
验证总计划→工艺调查表→验证方案→报告→验证总文件
过滤器的无菌保证
过滤设计
过滤性研究
加工
过滤器的灭菌
在线灭菌(SIP)验证
过滤器的完整性测试
产品规格参数
检测仪的IQ、OQ
过滤器性能
细菌截留
兼容性
析出物
吸附性
生物负荷的降低
取样设备IQ、OQ
微生物方法验证PQ性能
培训
滤器操作者资格证书
灭菌过程设计,SOP的执行
除菌级过滤器验证的项目
生物性质
毒性试验
微生物截留试验
菌种,安全性
浓度
体积
流速:2~4L/min,cm2
压力:0.2mPa~30psi
产品细菌截留验证
抑菌反应、裂菌反应
阴性对照
过程
灭菌
润湿:生理盐水
完整性
阴性对照
挑战
培养
物理性质
工艺参数的研究
压力
流速
压力速度曲线
温度
化学性质
析出物
可能影响药品纯度
化学兼容性
吸附